|

|
|
酵素について

 | はじめに | ||
| ビタミンやミネラルの効能を紹介していく中で、 たびたびその文中に登場して来た「酵素・補酵素」という言葉ですが、 わかったようでよくわからない、とにかくそういうものとして、 読み進めていた方も少なくないかと思います。そこで今回はビタミンやミネラルとも関連の深いこの酵素について詳しく見ていきます。 |
 | 酵素とは | ||
| 酵素は体の触媒ともよばれ、合成や分解など体の様々な化学反応において なくてはならないものです。 触媒とは化学反応の前後で、それ自身は変化せずに、反応のスピードを増減させるものです。 スピードを早めるものは正触媒、遅らせるものは負触媒と言います。 |
 | 酵素の働き | ||
|
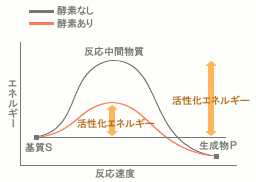
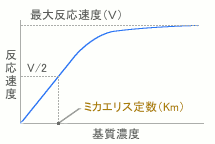
ある物質(基質S)から生成物(P)形成までの化学変化において、どのような場合でも基質はまずエネルギーレベルの高い反応中間物質を経て、生成物を作ります。 通常この過程では大きなエネルギーの障壁を越えなければいけません。 この障壁のことを活性化エネルギーといいます。 酵素は分子量1万から数百万まで幅のある大きなタンパク質分子で、 柔軟性に富み、特有の形状をしています。 酵素はその一部分に結合可能な特別な部分(活性部位)を持っていて、 活性部位に合う小さな基質分子の形を正確に見極め、自分にうまくはめ込んでいきます。 そうして基質と酵素が結びつくことで酵素-基質複合体を作ります。 この際の微妙な構造変化により、化学反応の際のエネルギーレベルを大きく引き下げる効果を発揮します。 その結果、化学反応が進みやすくなるというわけです。 ■活性化エネルギーについて
|
 | 酵素と補助因子について | ||
|
酵素は球状のたんぱく質で、たんぱく質のみで働くものと、たんぱく質以外の補助因子と結びついてはじめて機能するものとに分類することが出来ます。 補助因子にもいくつか種類があり、まずはマグネシウムやカルシウム、ナトリウムなどの金属イオンと低分子有機化合物とに分類されます。 低分子有機化合物はさらにビタミンB群を前駆体(ある物質になる前の段階のもの)として酵素とゆるやかに結合する補酵素と ビオチンやヘムなど共有結合で酵素としっかりと結合する補欠分子族とに分類されます。 補助因子を必要とするものでは、たんぱく質のみの部分をアポ酵素とよび、 補助因子と結合した状態のものをホロ酵素と呼びます。
|
 | 基質特異性、反応特異性 | ||
|
酵素は1つの基質にしか反応しないという基質特異性を備えます。また1つの反応のみに限局され、その他の副反応を引き起こさないという反応特異性も併せ持ちます。 酵素がどのようにして基質を見分けているのかについては諸説あるのですが、 これまでは、基質や酵素、活性部位の立体構造による【鍵と鍵穴説】が一般的でした。 最近では、基質が活性部位に近づくと活性部位が柔軟にその構造を変化させて、 基質と結合し、酵素・基質複合体を作るという【誘導適合説】という考え方が広まりつつあります。 |
 | 酵素の分類 | ||
|
酵素は様々な化学反応と関係しており、酵素の数も数千種類に及びます。 国際生化学連合(IUB)では、酵素をその作用に応じて 大きく6つの系統に分類しています。 ここではその6系統を反応別に3つのグループにわけて解説します。
|
 | 酵素反応に影響する様々な要因 | ||
通常化学反応は温度が高くなるほど活性化しますが、酵素の場合 至適温度を越えてくると熱変性を起こし活性が失われていきます。
体内の阻害剤では、代謝産物や酵素反応の最終産物が非競争阻害剤として、その量が増えてくると その一連の反応の最初の酵素の反応を阻害して、全体の代謝による生成物の量を調節するものがあります。このような流れをフィードバック制御と呼び、ここで調節を受ける酵素をアロステリック酵素といいます。
| |||||||||||||||||||||||||||||||||||||||
|
参考文献
栄養・健康化学シリーズ 生化学 栄養科学シリーズNEXT 生化学 基礎栄養学 健康・栄養科学シリーズ 絵とき 生化学入門 |
 ページTOPへ ページTOPへ
|
| text by 2005/04/11 |
|
since 2003/07/21 Copyright(C)2003 kain All Rights Reserved |






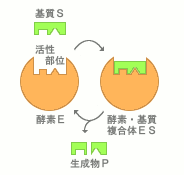 - たんぱく質のみ -
- たんぱく質のみ -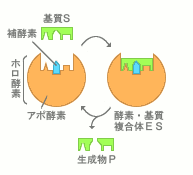 - 補助因子を含むもの -
- 補助因子を含むもの -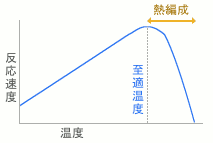

 生化学
生化学